Ikatan Kovalen: Pengertian, Jenis, Sifat dan Contohnya
JAKARTA, iNews.id - Ikatan kovalen adalah dalah satu dari beberapa macam dari ikatan kimia. Lantas, apa yang dimaksud ikatan kovalen dan contohnya? Simak penjelasannya di bawah ini.
Sebagian besar zat yang kita temui di dalam kehidupan sehari-hari adalah senyawa molekuler. Senyawa molekuler tersusun atas beberapa atom. Atom-atom dalam senyawa molekuler ini saling berkaitan satu sama lain melalui pemakaian bersama pasangan elektron.
Apa yang Dimaksud dengan Ikatan Kovalen?
Ikatan kovalen adalah ikatan antara atom berdasarkan pemakaian atom bersama. Elektron yang dipakai bersama ini berasal dari kedua atom yang berkaitan atau dari salah satu atom tersebut.
Untuk menggambarkan terjadinya ikatan kovalen biasanya menggunakan struktur Lewis. Terkadang untuk pasangan elektron digambarkan hanya dengan satu garis. Ikatan antara atom-atom Cl membentuk Cl2 dan antara atom-atom H dan Cl membentuk HCl dapat digambarkan seperti berikut :
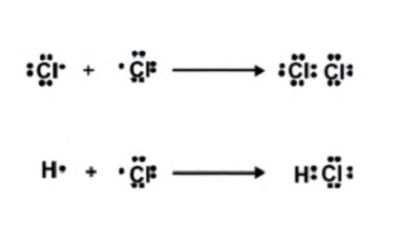
Dituding Sebarkan Video Syur Inara Rusli, Eva Manurung Sebut Virgoun Berhak Akses Rekaman CCTV
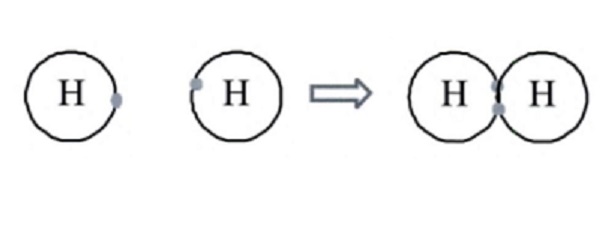
Penggambaran yang lebih jelas terjadinya ikatan kovalen dapat dilihat pada pembentukan ikatan antara atom H membentuk gas H2 seperti berikut ini :
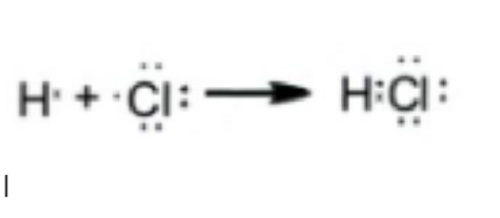
Elektron valensi untuk atom-atom yang berbeda digambarkan dengan labang yang berbebda agar lebih jelas elektron valensi atom, seperti contoh di HCl di atas, tanda silang untuk unsur yang pertama dan titik untuk unsur yang kedua sehingga menjadi
Jenis Ikatan Kovalen
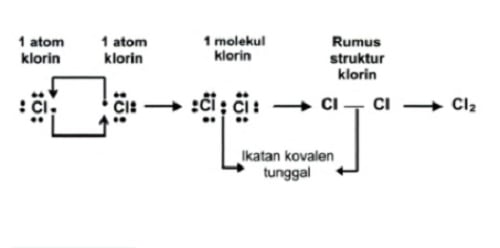
Ikatan kovalen tunggal adalah ikatan elektron yang digunakan bersama hanya satu pasang elektron. Contohnya adalah, pada pembentukan molekul klorin (Cl2)
17Cl : 2, 8, 7, jumlah elektron valensi = 7, yang berarti membutuhkan 1 e untuk mencapai kestabilan (oktet)
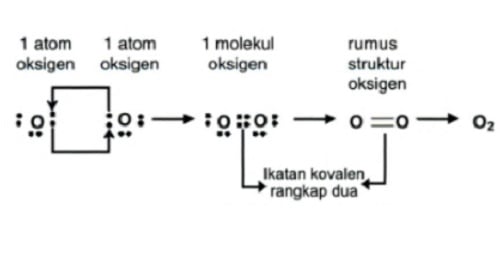
Ikatan ini merupakan elektron yang digunakan bersama dengan jumlah dua pasang elektron. Contohnya adalah pembentukan molekul oksigen (O2) :
8O : 2, 6, jumlah elektron valensi untuk = 6, yang berarti membutuhkan 2 e untuk mencapai kestabilan (oktet).
Axelo Resmi Debut Lewat Single Amit-Amit
Ikatan ini merupakan elektron yang jika digunakan bersama berjumlah tiga pasang elektron.
Contohnya adalah pembentukan molekul nitrogen (N2) :
7N : 2, 5, jumlah elektron valensi = 5, yang berarti membutuhkan 3e untuk mencapai kestabilan (oktet)

Ikatan polar ini terjadi bila pasangan elektron yang dipakai bersama memihak atau mengutub ke salah satu atom atau gugus atom. Hal ini terjadi karena adanya perbedaan elektronegativitas yang besar antar atom yang berkaitan.
Elektronegativitas setiap unsur dapat dilihat pada tabel di bawah:

Contoh senyawa yang berikatan dengan kovalen polar adalah molekul HCl, yang di mana antara atom H dan Cl memiliki perbedaan elektronegativitas yang besar, yaitu H = 2,1 dan Ci = 3,0. Pasangan elektron yang dipakai bersama akan meng kutub ke arah atom Cl yang memiliki elektronegativitas yang lebih besar.
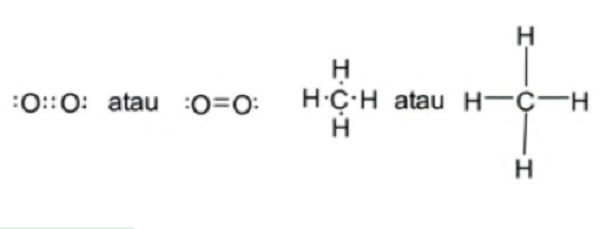
Ikatan nonpolar ini dapat terjadi apabila pasangan elektron yang dipakai bersama berasal dari atom yang sama, sehingga memiliki elektronegativitas yang sama seperti O2, H2, Cl2, F2, N2 dan sebagainya.
Selain itu, dapat hal ini juga dapat terjadi pada molekul yang simetris di mana satu atom diikat oleh beberapa atom yang sama sehingga pasangan elektron yang dipakai bersama tidak bergerak atau meng kutub ke salah satu atom. Contohnya seperti gambar di bawah :
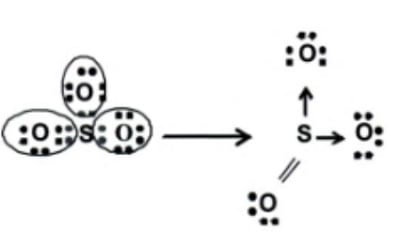
Ikatan koordinasi ini adalah ikatan kovalen yang terbentuk apabila penggunaan elektron bersama berasal dari salah satu atom yang berkaitan. Sedangkan atom lain menerima pasangan elektron yang digunakan bersama.
Pasangan elektron membentuk ikatan dativ digambarkan dengan anak panah kecil yang arahnya menuju atom yang menerima pasangan elektron. Contohnya adalah, ikatan koordinasi pada molekul belerang trioksida (SO3). Satuan ikatan S-O dalam SO3 adalah ikatan rangkap, sedangkan dua ikatan yang lain merupakan kovalen koordinasi. Hal ini terjadi karena atom pusat (S) memiliki 6 elektron valensi, jadi hanya memerlukan tambahan 2 elektron. Pembentukan senyawa ini dapat digambarkan dengan lambang Lewis seperti berikut ini :
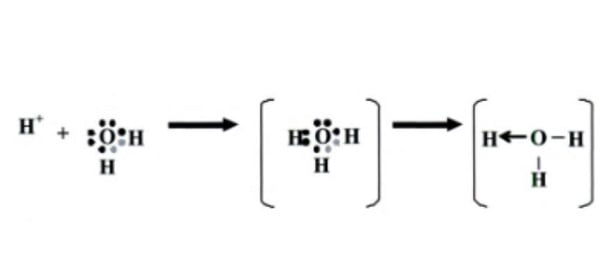
Ion hidronium ini terbentuk dari satu ion hidrogen yang terikat oleh satu molekul air.
Sifat Senyawa Kovalen
Ikatan ini memiliki sifat yang berlawanan dengan sifat senyawa ionik. Senyawa kovalen secara umum memiliki sifat seperti berikut ini:
a.Senyawa kovalen pada umumnya memiliki titik leleh dan titik didih yang rendah. Di alam mereka berbentuk gas seperti H2, O2, N2, HCl dan CO2), cair (H2O) atau padatan yang mudah meleleh.
b.Titik didih dan titik lelehnya sangat rendah karena gaya tarik menarik antar molekulnya lemah. Beberapa senyawa kovalen memiliki jaringan yang erat antar molekulnya sehingga disebut sebagai padatan kovalen jaringan. Keadaan tersebut menyebabkan tidak ada molekul yang terpisah. Semua molekul terikat dalam ikatan kovalen tiga dimensi. Senyawa kovalen semacam itu memiliki titik leleh yang tinggi dan sangat keras. Contohnya adalah intan dan kuarsa (SiO2)
c.Pada umumnya tidak larut dalam pelarut polar (air), akan tetapi larut dalam alkohol, eter dan sebagainya (pelarut non polar atau organik)
d.Senyawa kovalen merupakan penghantar listrik yang buruk, bahkan jika dilelehkan atau dilarutkan dalam air. Tetapi ada yang dapat menghantarkan arus listrik seperti HCl, tetapi ada pula yang tidak dapat menghantarkan arus listrik seperti O2, I2, H2.
Itulah pengertian, macam dan sifat dari ikatan kovalen. Semoga membantu!

