Sifat Koligatif Larutan Elektrolit dan Nonelektrolit: Pengertian, Manfaat serta Contoh Soalnya
JAKARTA, iNews.id - Sifat koligatif larutan merupakan salah satu topik bahasan dalam mata pelajaran kimia di bangku sekolah. Apakah teman-teman di sini sudah memahami topik yang satu ini? Jika belum, simak informasinya di bawah ini.
Apa yang Dimaksud dengan Sifat Koligatif Larutan?
Sifat penting larutan tergantung pada banyaknya partikel zat terlarut dalam larutan dan tidak tergantung pada jenis partikel zat terlarut. Sifat-sifat tersebut dinamakan sifat koligatif larutan.
Dalam suatu larutan banyaknya partikel ditentukan oleh konsentrasi larutan dan sifat itu sendiri. Jumlah partikel yang ada dalam larutan nonelektrolit tidak sama dengan jumlah partikel yang ada dalam larutan elektrolit, meskipun keduanya memiliki konsentrasi yang sama.
Hal tersebut dikarenakan larutan elektrolit dapat terurai menjadi ion-ionnya, sedangkan larutan nonelektrolit tidak dapat terurai menjadi ion-ion. Oleh karena itu, sifat koligatif dibedakan menjadi dua, yakni sifat koligatif larutan nonelektrolit dan sifat koligatif larutan elektrolit.
Sifat koligatif larutan nonelektrolit sangat berbeda dengan sifat koligatif larutan elektrolit, hal ini karena larutannya tidak dapat terurai ion-ionnya. Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi pada jumlah zat terlarut yang larut pada suatu larutan.
Larutan elektrolit memperlihatkan sifat koligatif yang lebih besar. Hal tersebut diakibatkan ion-ion yang terdapat dalam larutan elektrolit dapat terurai sehingga menyebabkan perbedaan antara larutan elektrolit dan nonelektrolit.
Manfaat sifat koligatif antara lain:
- Sebagai penurunan tekanan uap
- Peningkatan titik didih
- Penurunan titik beku
- Tekanan osmotik
Contoh soal rangkuman sifat koligatif larutan
1. Larutan urea 2,5 molal dibuat dengan mencampurkan urea sebanyak?
a. 60 g
b. 80 g
c. 100 g
d. 120 g
e. 150 g
2. Dari pernyataan berikut ini manakah yang benar?
a. Tekanan uap jenuh pelarut murni lebih rendah daripada larutannya
b. Tekanan uap larutan lebih tinggi dari pelarutnya
c. Titik didih larutan lebih tinggi daripada titik didih pelarutnya
d. Titik didih pelarut lebih tinggi daripada titik didih larutannya
e. Titik beku larutan lebih tinggi daripada titik beku pelarut murninya
3. Tekanan uap jenuh air murni pada suhu 23 derajat celcius adalah 21 mmHg. Pada suhu yang sama larutan 15 gram urea dalam 90 gram air memiliki tekanan uap jenuh sebesar?
a. 19,00
b. 19,40
c. 19,60
d. 19,80
e. 20,00
4. Lihatlah tabel di bawah ini!
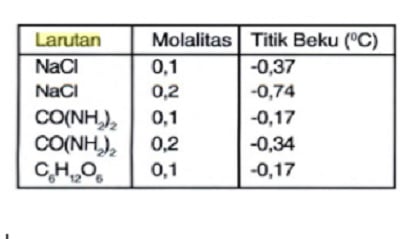
Berdasarkan data tersebut dapat disimpulkan bahwa penurunan titik beku larutan tergantung pada?
a. Jenis pelarut
b. Semua zat pelarut
c. Jumlah partikel zat terlarut
d. Konsentrasi molal larutan
e. Jenis partikel zat terlarut
5. Sebanyak 3 gram suatu zat nonelektrolit dilarutkan dalam 100 gram air, ternyata membeku pada suhu -0,9 derajat celcius, maka larutan tersebut memiliki titik didih sebesar?
a. 100,25 derajat celcius
b. 100,125 derajat celcius
c. 100,5 derajat celcius
d. 101,25 derajat celcius
e. 102 derajat celcius
6. Dengan massa yang sama senyawa-senyawa di bawah ini yang memiliki titik beku terendah adalah?
a. urea (Mr=60)
b. etilen glikol (Mr= 62)
c. NaOH (Mr= 40)
d. glukosa (Mr= 180)
e. Sukrosa (Mr= 342)
7. Untuk membuat larutan urea 500 mL yang isotonik dengan Larutan KCI 0,1 M diperlukan urea sebanyak?
a. 1,2 gram
b. 2,4 gram
c. 3 gram
d. 6 gram
e. 7,2 gram
8. Suatu senyawa dengan rumus empiris C4H2N. Bila 3,84 gram senyawa tersebut dilarutkan dalam 500 gram benzena (K1benzena= 5,12 derajat celcius/m) mengalami penurunan titik beku sebesar 0,307 derajat celcius maka rumus senyawa tersebut adalah?
a. C4H2N
b. C8H4N2
c. C8H4N8
d. C6H4N4
e. C4H8N2
9. Apabila 12 gram sukrosa (Mr= 342) dilarutkan dalam air hingga volum larutan menjadi 250 mL, pada suhu 27 derajat celcius memiliki tekanan osmosis sebesar?
a. 0,31
b. 2,16
c. 3,42
e. 3,45
10. Sebanyak 0,4 molal garam NaCl mempunyai titik beku sebesar -1,488 derajat celcius. Jika K1 air = 1,86 derajat celcius/m besarnya derajat ionisasi garam tersebut adalah?
a. 0,2
b. 0,48
c. 0,50
d. 0,74
e. 1,00
Demikian informasi mengenai sifat koligatif larutan elektrolit dan nonelektrolit, manfaat, serta contoh soalnya. Semoga dapat bermanfaat. Semangat terus belajarnya ya!










